

甲基汞(methylmercury,MeHg)是汞的一种有机化合物,也是含汞化合物中最具毒性的代表。甲基汞分子量小,碳链短,非电离,脂溶性大,极易透过血脑屏障,进入生物体内而富集,对人体造成以神经系统为主的全身性损害[1],因此甲基汞的环境容量和毒理性研究一直是学者们关注的热点之一。
20世纪50年代,日本水俣镇一家氮肥公司将大量的氯化汞(HgCl2)和硫酸汞(HgSO4)两种化学物质直接排入水俣湾中,导致这两种汞的化合物大部分吸附在水俣湾的沉积物中,沉积物中的无机汞在微生物甲基化作用下变成毒性十分强烈的甲基汞[2- 4]。研究发现,水俣病暴发时,水俣湾沉积物中的甲基汞浓度高达2 010μg/g[5]。沉积物中超高浓度的甲基汞通过沉积物-水界面的扩散作用进入海水,海水中的甲基汞通过食物链的富集作用,最终造成了严重的生物资源污染和人类健康损害[6]。
自然界中甲基汞的来源是单质汞通过一系列化学反应生成的。甲基汞广泛存在于海洋、海洋沉积物、湖泊、湖泊沉积物、陆地土壤、海洋和陆地的各种动植物内,但是其含量却相当的小。表1列出了前人对甲基汞测定的部分结果。

尽管甲基汞在自然界中,尤其是在海水中的含量很低,但是甲基汞具有生物富集和生物扩大的特性。甲基汞在海洋生物中的富集系数普遍较高,有时甚至高达107,如此高的生物富集因子经常导致鱼体内的甲基汞含量超过W H O的健康标准(0. 5μg/g)[8]。前人的研究也指出海水中的甲基汞含量大约只占海水中总汞的1%,而鱼体内的甲基汞含量却占到了鱼体总汞含量的90%[12]。王嵩等指出淡水鱼和浮游植物能将甲基汞富集1 000倍,淡水无脊椎动物可以富集10万倍,海洋植物可以富集100倍,海洋动物可以富集20万倍[1]。Lehnherr也指出,在温暖的湿地或湖泊中,浮游动物(干重)中的甲基汞含量可以达到880 ng/g[13]。由此可见,不同海洋生物对甲基汞的富集系数不同,海洋生物在食物链的位置越靠近顶端,此种海洋生物的富集系数就越大,而人类无疑是甲基汞的最终不可逆归宿。
在北极生物圈中,海水甲基汞的含量为(10- 8~ 10- 7)×10- 6;海水中的藻类和悬浮物含量为(10- 3 ~ 10- 2)×10- 6,海水甲基汞被富集了105倍;浮游植物和无脊椎动物中含量为(10- 2~ 10- 1)×10- 6;鱼体内的含量为(10- 1~ 100)×10- 6;顶级猎食者体内的含量为(100~> 101)×10- 6。由此可以很明显地看出,甲基汞含量随食物链金字塔逐级向上富集[14]。
海洋中的甲基汞主要在海水表层或亚表层中生成。Hg在海水中很容易被氧化为Hg(Ⅱ), Hg(Ⅱ)在海洋中的甲基化通过海水中的最初生产和微生物异氧呼吸同碳循环紧密相连。Sunderland等指出在水体中的甲基汞的生产同水体中间层(150~ 1 000 m)异氧呼吸相关联[15]。在北极大洋生态系统,Hg(Ⅱ)在水体中的甲基化相对于在底层的沉积物甲基化而言,是甲基汞的主要来源[14],越来越多的证据也指出,在开放大洋Hg(Ⅱ)在水体中的甲基化相对于在底层沉积物的甲基化更能成为甲基汞的主要来源[15- 20]。尽管甲基化汞的最高浓度出现在亚表层,但Hg的稳定同位素失踪实验表明:Hg(Ⅱ)的甲基化发生在表层海水中[21]。Hammers的研究也表明,大多数在海洋食物链中生物积累的甲基汞实际上产生在表层混合层[22]。
由图1可以看出,海洋中甲基汞最主要的来源是甲基化反应(0. 76)和二甲基汞的分解(0. 80),其次是沉积物的释放,环境和径流输入,大气沉降所含比重最少。海洋中甲基汞的最主要去除途径为甲基汞的去甲基化(1. 20)、甲基汞的沉降(0. 44)和生物吸收(0. 2)。
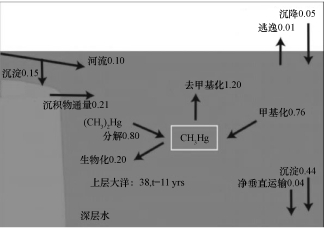
甲基汞和海洋生物,尤其是浮游植物的关系最引人注目。Lee等[23]研究了量化海水浮游植物中甲基汞浓度,提出浮游植物是甲基汞进入水产食物链的关键入口;外界条件如光照、温度和营养条件等对浮游植物获取甲基汞没有直接的影响,外界条件只是影响到了浮游植物的生长,浮游植物对甲基汞的获取取决于浮游植物细胞的表面积与体积比,并指出藻类在不同环境下摄取量的变化是不同海洋生态系统中形成甲基汞浓度差异的主因。也正是进入藻类的这部分甲基汞浓度将成为威胁人类健康的主要甲基汞。
在北极的淡水中,甲基汞浓度是两个过程相抵的结果:Hg(Ⅱ)在湖泊和池塘底泥的甲基化和甲基汞在水体中的光致去甲基化[14]。细菌去甲基化通过两种途径:氧化途径[24]和还原途径。氧化途径产生Hg(Ⅱ),CO2和CH 4;还原机理通过有机汞裂合酶调节产生Hg(0)和CH 4 [25]。细菌活性控制着甲基化和去甲基化的速率参数,因此,净甲基化可表达为:Net Me Hg production= km Hg(Ⅱ)- kd Me-Hg。km表示甲基化的速率常数,kd表示去甲基化的速率常数[14]。
汞的生物甲基化是微生物通过一系列的代谢途径将甲基传递给汞生成甲基汞的过程。最早关于汞的生物甲基化的报道是1968年Wood发现沉积物中的甲基钴胺素利用产烷细菌可以导致汞的甲基化[26]。研究表明,许多有机体,像藻类、真菌、细菌等,在纯种培养实验中都可以把Hg(Ⅱ)转化为甲基汞(MeHg)[27]。Siciliano等利用一种甲基汞转移酶的示踪来定量汞的甲基化,并利用已发表的速率常数计算出甲基转移酶活性和净甲基汞含量的相关系数,这种方法可应用于不同环境的甲基汞生成监测[28]。一般来说,甲基化速率取决于生物可利用的Hg(Ⅱ)的量和甲基细菌的活性[29]。
甲基汞的生产速率=生物可利用的Hg(Ⅱ)×甲基细菌的活性
如果把汞的生物甲基化作用称为生化反应的话,那么汞的非生物甲基化就是纯粹的化学反应。尽管汞的甲基化被公认为生物甲基化为主导,但是汞的非生物甲基化作用广泛存在于自然界已经成为不争的事实。Horvat等在研究中发现,在切断水体的外在汞源之后,水中的甲基汞并没有出现预期的降低,究其原因,在低氧或厌氧条件下,沉积物中的汞会通过各种甲基化作用释放到水体,维持水体中甲基汞的高含量[30]。有研究指出,在无氧环境下,富硫和富有机物的水体通常含有较高的甲基汞,这一过程主要是巯基介入汞的络合化进程而造成的,甲基汞在临界点的不完全释放也是导致汞的非生物甲基化反应产生的原因之一[4]。
一般来说,淡水系统中汞的甲基化的反应场所,主要是沉积物及沉积物—水体界面。但有研究表明,大洋生态系统中,表层水体是比底泥更重要的甲基汞生产场所。在大洋生态系统中,甲基汞由二价无机汞离子通过细菌在深层底泥和大洋水体中产生,淡水系统和湿地也产生甲基汞,它们由河流运输到海洋表层。此外,沼泽和湿地也是产生甲基汞的重要场所。而Guimarães等在研究洪泛平原的甲基汞生产情况时,发现水生植物根部的甲基汞含量高于表层沉积物和洪泛土壤[31]。
甲基化细菌主要是硫酸盐还原菌(sulfate-re-ducing bacteria,SRB)和铁还原菌(iron-reducing bacteria,IRB),但是并非所有的硫酸盐还原菌和铁还原菌都产生甲基汞,只有部分亚类或菌株能产生甲基汞[32]。表2列出了目前已经证实的可以产生甲基汞的细菌和真菌。
甲基化细菌在厌氧条件下将无机汞转化为甲基汞。作为汞甲基化反应的生物驱动者,甲基化细菌的活性高低直接影响了汞甲基化反应的进行。沉积物中汞甲基化细菌的分布影响甲基汞生成的空间位置和甲基化率[32],这也反映了甲基化细菌是海洋沉积物中甲基汞空间分布的决定性作用。Gilmour等在研究Quabbin Reservoir时发现,硫酸盐还原菌在沉积物剖面中的垂直分布同甲基汞相似,并且当采取一定措施来抑制硫酸盐还原菌时,所有深度层的甲基汞的生成都受到阻碍[33],但有实验指出北极湿地的土壤能够在实验室条件下将Hg(Ⅱ)甲基化,在此过程中,硫酸还原菌并非主要的甲基化细菌[34- 35]。可见介质的不同,甲基化细菌产生作用的机理也不尽相同。
正如前文所述,硫酸盐还原菌作为汞的甲基化反应的生物驱动者,其甲基化活性受周围环境中的SO42-浓度的影响较大[36],因此汞的微生物甲基化高度依赖硫酸盐的浓度,最适宜的硫酸盐浓度是0. 3 mmol/L。硫酸盐在Hg(Ⅱ)甲基化过程中扮演了特别复杂的角色。Compeau等认为硫酸盐还原菌对Hg(Ⅱ)的甲基化效率完全表达需满足两个条件:一是硫酸盐浓度受限;二是存在可发酵的有机酶作用物[2]。低浓度的硫酸盐(200~ 500μM)限制了硫酸盐的减少,延长了Hg(Ⅱ)的甲基化时间[33],从而降低了甲基化效率。然而在高硫酸盐浓度下,较高的硫酸盐消耗,导致硫化物浓度上升,降低了生物可利用的Hg(Ⅱ)。究其原因是硫酸盐还原后产生的离子和生物可利用Hg(Ⅱ)结合,形成HgS沉淀或形成Hg- S带电基团Hg(SH)-和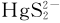 ,以上两种带电基团都比中性的Hg- S基团更缺乏生物可利用性[37- 38]。汞的甲基化是一个非常庞大的、复杂的、多样性的反应,而硫酸盐浓度仅仅影响硫酸盐还原菌,是否有其他细菌也能产生甲基汞或者海水中存在大量的非生物甲基化作用产生的甲基汞,这些都还需进一步对海洋这个多界面体系中汞甲基化过程进行全面系统的研究。
,以上两种带电基团都比中性的Hg- S基团更缺乏生物可利用性[37- 38]。汞的甲基化是一个非常庞大的、复杂的、多样性的反应,而硫酸盐浓度仅仅影响硫酸盐还原菌,是否有其他细菌也能产生甲基汞或者海水中存在大量的非生物甲基化作用产生的甲基汞,这些都还需进一步对海洋这个多界面体系中汞甲基化过程进行全面系统的研究。
环境的营养程度并不直接影响甲基汞的反应过程。任家盈[10]等在研究太湖中营养状态和沉积物中甲基汞分布特征的关系时指出,太湖表层沉积物甲基汞含量与其营养程度有所差异,而与表层沉积物有机质含量大小顺序一致,说明了沉积物中有机质含量对甲基汞的分布有一定的影响。硝酸盐浓度增加和其他电子接受体,像Mn4+和Fe3+,在热力学上通过细菌降解有机物质的能力超过了硫酸盐,导致硫酸还原菌活性的降低以及延长和减弱了Hg(Ⅱ)甲基化的速率[39]。严重的富营养化和较高的有机质埋藏是环境问题日益突出的近海水域普遍存在的特征,因此理清海洋环境中,只有区分出以上两种因素对汞甲基化反应的影响,才能为各国环境治理政策的出台提供有利的科学依据。
还有氧化还原因素也参与汞的生物甲基化过程。它通过控制汞的化学形态和配体特征来控制生物可利用的汞[40]。另外,还有溶解有机物质,在多层面控制着甲基汞的生产。有机碳基质的可利用性可以限制细菌的降解和Hg(Ⅱ)的甲基化速率[41- 43]。此外,在低p H环境下,甲基汞产生速率加快,可能由于生物可利用的Hg(Ⅱ)随p H的降低而增多或者由于使Hg(Ⅱ)甲基化的微生物在低p H的范围甲基化能力变强[44]。另外,温度和光照也是影响甲基化的参数。
对于甲基汞的研究,国外学者多着眼于大洋的甲基汞分布特征和甲基汞在所在的生态系统的循环(包括极地),同时也注重研究甲基汞的暴露对人类健康的影响。国内学者则多数进行湖泊以及水产品的甲基汞监测工作,从海洋层面和宏观层面对甲基汞的研究尚较少。现阶段,随着社会的发展,虽然各个国家政府已经意识到环境保护的重要性,但汞每年进入生物圈的量依旧惊人,未来人类暴露于甲基汞的压力与日俱增。
若要保护人类免受甲基汞的侵害,避免水俣病事件悲剧的重演,未来对甲基汞研究工作亟须在以下两点开展或加强:①加强机理方面的研究。甲基汞各个地域的浓度千差万别,需要强化机理研究,弄清到底是何种原因导致浓度的差异,以便更进一步的研究或制定切实有效的应对之策。②方法的改进和完善。目前甲基汞的测试方法复杂繁琐,样品测试周期过长,亟须开发一套快捷便利的测试方法,以利甲基汞研究的快速广泛开展。